

El hallazgo casual del fullereno se produjo al irradiar un disco de grafito con un laser y mezclar el vapor de carbono resultante mediante una corriente de helio. Cuando se examinó el residuo cristalizado, se encontraron moléculas constituidas por 60 átomos de carbono. Intuyendo que estas moléculas tenían una forma semejante a la cúpula geodésica construida con motivo de una Exposición Universal en Montreal en 1967 por el arquitecto Buckminster Fuller, fueron nombradas como Buckminsterfullerenos o más comunmente como fullerenos
Se trata de un material obtenido por interacción de átomos de carbono C60 en fase gaseosa, logrando que los átomos de carbono se unieran en hexágonos y con dobles enlaces resonantes entre átomos de carbono vecinos, como si se tratara del benceno.
En la Unión de Arizona y en el Instituto Max Planck, a través de descargas eléctricas con electrodos de grafito en atmósfera de helio y disolución en tolueno, pudo obtenerse un polvo que permitió su estudio mediante espectrometría infrarroja-resonancia magnética nuclear y difracción de rayos X. Así se pudo identificar el Fullereno C60 y definir su estructura por medio de los típicos modelos orgánicos (12 pentágonos - 20 hexágonos con átomos de carbono tetravalente en los vértices). Otras estructuras se fueron descubriendo desde los C16 a C60 que pudieron corroborar para el más escéptico la estructura de balón similar a la pelota olímpica del fútbol mundial. En esa configuración los átomos de carbono de los hexágonos tienen dobles enlaces resonantes entre átomos vecinos como si se tratara del benceno.

Aplicaciones
Los polímeros son, sin duda, uno de los materiales que han encontrado una mayor aplicación debido a sus múltiples propiedades, así como también por su fácil procesabilidad y manejo. Gracias a la incorporación de fullerenos en los polímeros, se conseguirían propiedades electroactivas y de limitación óptica. Esto podría tener sobre todo aplicación en recubrimiento de superficies, dispositivos conductores y en la creación de nuevas redes moleculares.
También son de aplicación en el campo de la medicina, gracias a sus propiedades biológicas. A este respecto, se consiguió que un fullereno soluble en agua mostrara actividad contra los virus de inmunodeficiencia humana que causan el SIDA.
Toxicidad
Considerando la reactividad de los fullerenos, éstos se tornan potencialmente tóxicos sobre todo si se toma en cuenta que son materiales lipofílicos que tienden a ser almacenados por los organismos en zonas de tejidos grasos. De ahí que Eva Oberdorster haya corroborado que los fullerenos como el C60 pueden inducir un estrés oxidante en los cerebros de los peces róbalo. Más aun, Lovern y Klaper sugieren un considerable grado de mortalidad del Daphnia Magna (un diminuto crustáceo, popular alimento para peces de acuario, y usualmente utilizado por su sensibilidad en estudios de ecotoxicológicos) cuando son expuestos a nanopartículas de dióxido de titanio (TiO2) y al fullereno C60.
Otros estudios han señalado que, además de que ciertos nanomateriales podrían ser efectivos como agentes bactericidas tanto para bacterias positivas como negativas en un cultivo dado, en particular los fullerenos del tipo C60 podrían potencialmente inhibir de modo importante el crecimiento y la respiración de los microbios.
Hasta los años ochenta solo se conocían dos formas alotrópicas del carbono elemental, que eran el grafito, en el cual los átomos de carbono forman capas de anillos hexagonales y planos de carbono, donde cada átomo de carbono se une a otros tres de una misma capa y no hay enlaces covalentes entre los átomos de carbono de diferentes capas las cuales se mantienen unidas por débiles interacciones de Van der Waals. De esta forma el grafito esta constituido por capas formadas por anillos aromáticos fusionados. La otra forma es el diamante, en el cual los átomos de carbono se encuentran unidos por fuertes enlaces covalentes donde cada átomo de carbono se une tetraédricamente a otros cuatro formando una red tridimensional que es la que le proporciona la rigidez y dureza típica del diamante.
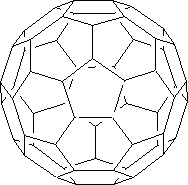
En 1985 los Profesores Kroto y Smalley, cuando estaban realizando experimentos en los que se trataba de convertir carbono gaseoso en partículas (hollín), fenómeno que se produce en las estrellas, encontraron unas nuevas estructuras estables de las cuales la más abundante fue una molécula de fórmula C60, la cual constituye una nueva forma de carbono, junto con ella se obtuvo en menor medida el C70.
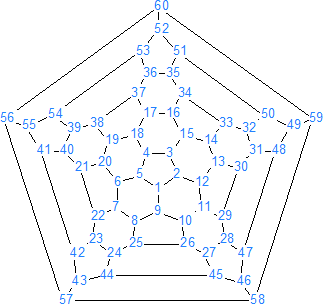
En el C60 cada átomo de carbono esta unido a otros tres átomos utilizando para ello orbitales sp2 con un electrón en cada orbital. El cuarto electrón de valencia de cada carbono se encontraría en un orbital p perpendicular a la superficie esférica, de esta manera los orbitales se solapan formando un continuo de orbitales con electrones p por dentro y fuera de la esfera de igual forma a como tiene lugar en el benceno con los seis electrones p que le confieren el carácter aromático. Esto hace que podamos considerar a los fullerenos como una esfera aromática y estable.
La estructura del C60 es similar a la de una pelota de fútbol (de ahí el nombre de futbolanos o buckybolas como también se les conoce) es decir, tiene forma de un icosaedro truncado con 60 vértices, en cada uno de los cuales se encuentra un carbono. Tiene 32 caras, de las cuales 12 son pentágonos y las 20 restantes son hexágonos, además cada pentágono esta rodeado de cinco hexágonos, de forma que dos pentágonos no pueden ser adyacentes entre sí, pero los seis enlaces de cada hexágono están fusionados alternadamente a tres pentágonos y tres hexágonos.
En general, se conoce con el término de fullerenos (en honor del arquitecto Buckminster Fuller) a todas aquellas estructuras formadas por anillos pentagonales y hexagonales.
En cuanto al comportamiento químico de este tipo de compuestos, aún cuando no son aromáticos en el sentido de cómo lo es el benceno, experimentan reacciones de adición al doble enlace (no pueden experimentar reacciones de sustitución ya que no tienen hidrógenos).
C60 ![]() C60Br2 + C60 Br4
C60Br2 + C60 Br4
También es capaz de reaccionar con el cloro a temperaturas mayores (>300ºC).
Hay que tener en cuenta que los 60 carbonos son equivalentes (como sucede en el benceno) pero no así los enlaces. El C60 presenta dos tipos de enlaces, losenlaces 6-6 compartidos por hexágonos adyacentes y los enlaces 5-6 compartidos por un pentágono y un hexágono. Los enlace 6-6 son más cortos (1,39 A) que los enlaces 5-6 (1,43 A) y son más parecidos a los dobles enlaces por lo cual la mayoría de las adiciones se llevan a cabo en un enlace 6-6.
La importancia que tiene el descubrimiento de estos tipos de moléculas es que abre un nuevo campo de posibles aplicaciones en la elaboración de nuevos tipos de polímeros, superconductores, estructuras con metales o con otros átomos atrapados dentro de estos agrupamientos de carbono, así como nuevos catalizadores, productos farmacéuticos y otras posibles aplicaciones industriales.
El hallazgo casual del fullereno se produjo al irradiar un disco de grafito con un laser y mezclar el vapor de carbono resultante mediante una corriente de helio. Cuando se examinó el residuo cristalizado, se encontraron moléculas constituidas por 60 átomos de carbono. Intuyendo que estas moléculas tenían una forma semejante a la cúpula geodésica construida con motivo de una Exposición Universal en Montreal en 1967 por el arquitecto Buckminster Fuller, fueron nombradas como Buckminsterfullerenos o más comunmente como fullerenos
Se trata de un material obtenido por interacción de átomos de carbono C60 en fase gaseosa, logrando que los átomos de carbono se unieran en hexágonos y con dobles enlaces resonantes entre átomos de carbono vecinos, como si se tratara del benceno.
En la Unión de Arizona y en el Instituto Max Planck, a través de descargas eléctricas con electrodos de grafito en atmósfera de helio y disolución en tolueno, pudo obtenerse un polvo que permitió su estudio mediante espectrometría infrarroja-resonancia magnética nuclear y difracción de rayos X. Así se pudo identificar el Fullereno C60 y definir su estructura por medio de los típicos modelos orgánicos (12 pentágonos - 20 hexágonos con átomos de carbono tetravalente en los vértices). Otras estructuras se fueron descubriendo desde los C16 a C60 que pudieron corroborar para el más escéptico la estructura de balón similar a la pelota olímpica del fútbol mundial. En esa configuración los átomos de carbono de los hexágonos tienen dobles enlaces resonantes entre átomos vecinos como si se tratara del benceno.

Aplicaciones
Los polímeros son, sin duda, uno de los materiales que han encontrado una mayor aplicación debido a sus múltiples propiedades, así como también por su fácil procesabilidad y manejo. Gracias a la incorporación de fullerenos en los polímeros, se conseguirían propiedades electroactivas y de limitación óptica. Esto podría tener sobre todo aplicación en recubrimiento de superficies, dispositivos conductores y en la creación de nuevas redes moleculares.
También son de aplicación en el campo de la medicina, gracias a sus propiedades biológicas. A este respecto, se consiguió que un fullereno soluble en agua mostrara actividad contra los virus de inmunodeficiencia humana que causan el SIDA.
Toxicidad
Considerando la reactividad de los fullerenos, éstos se tornan potencialmente tóxicos sobre todo si se toma en cuenta que son materiales lipofílicos que tienden a ser almacenados por los organismos en zonas de tejidos grasos. De ahí que Eva Oberdorster haya corroborado que los fullerenos como el C60 pueden inducir un estrés oxidante en los cerebros de los peces róbalo. Más aun, Lovern y Klaper sugieren un considerable grado de mortalidad del Daphnia Magna (un diminuto crustáceo, popular alimento para peces de acuario, y usualmente utilizado por su sensibilidad en estudios de ecotoxicológicos) cuando son expuestos a nanopartículas de dióxido de titanio (TiO2) y al fullereno C60.
Otros estudios han señalado que, además de que ciertos nanomateriales podrían ser efectivos como agentes bactericidas tanto para bacterias positivas como negativas en un cultivo dado, en particular los fullerenos del tipo C60 podrían potencialmente inhibir de modo importante el crecimiento y la respiración de los microbios.
